Page 56 - Pharma Paper Review
P. 56
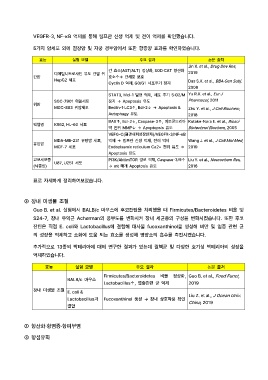
VEGFR-3, NF-κB 억제를 통해 림프관 신생 억제 및 전이 억제를 확인했습니다.
5가지 암세포 외에 결장암 및 자궁 경부암에서 또한 항종양 효과를 확인하였습니다.
효능 실험 모델 주요 결과 논문 출처
Jin X. et al., Drug Dev Res,
간 효소(AST/ALT) 정상화, SOD·CAT 항산화
디에틸니트로사민 유도 간암 쥐 2019
간암 효소↑→ 간세포 보호
HepG2 세포 Das S.K. et al., BBA Gen Subj,
Cyclin D 억제, G0/G1 세포주기 정지
2008
STAT3, Mcl-1 발현 억제, 세포 주기 S·G2/M Yu R.X. et al., Eur J
SGC-7901 위암세포 정지 → Apoptosis 유도 Pharmacol, 2011
위암
MGC-803 위암세포 Beclin-1·LC3↑, Bcl-2↓ → Apoptosis & Zhu Y. et al., J Cell Biochem,
Autophagy 유도 2018
BAX↑, Bcl-2↓, Caspase-3↑, 미토콘드리아 Kotake-Nara E. et al., Biosci
백혈병 K562, HL-60 세포
막 전위 MMP↓ → Apoptopsis 유도 Biotechnol Biochem, 2005
VEFG-C(혈관내피성장인자)/VEGFR-3/NF-кB
MDA-MB-231 유방암 세포, 억제 → 림프관 신생 억제, 전이 억제 Wang J. et al., J Cell Mol Med,
유방암
MCF-7 세포 Endoplasmic reticulum Ca2+ 전위 유도 → 2019
Apoptosis 유도
교모세포종 U87, U251 세포 PI3K/Akt/mTOR 경로 억제, Caspase-3/9↑ Liu Y. et al., Neurochem Res,
(뇌종양) → mt 매개 Apoptosis 유도 2016
표로 자세하게 정리하여보았습니다.
③ 장내 미생물 조절
Guo B. et al. 실험에서 BALB/c 마우스에 후코잔틴을 처리했을 때 Firmicutes/Bacteroidetes 비율 및
S24-7, 장내 유익균 Acherman의 풍부도를 변화시켜 장내 세균총의 구성을 변화시켰습니다. 또한 후코
잔틴은 직접 E. coli와 Lactobacillus에 결합해 대사물 fucoxanthinol을 생성해 비만 및 염증 관련 균
의 성장을 억제하고 소화에 도움 되는 효소를 생성해 영양소의 흡수를 촉진시켰습니다.
추가적으로 13종의 박테리아에 대해 연구한 결과가 있는데 결핵균 및 다양한 호기성 박테리아의 성장을
억제하였습니다.
효능 실험 모델 주요 결과 논문 출처
Firmicutes/Bacteroidetes 비율 정상화, Guo B. et al., Food Funct,
BALB/c 마우스
Lactobacillus↑, 염증관련 균 억제 2019
장내 미생물 조절 E. coli &
Lactobacillus과 Fucoxanthinol 생성 → 장내 상호작용 확인 Liu Z. et al., J Ocean Univ.
China, 2019
결합
④ 항산화·항염증·항피부염
⑤ 항섬유화